Использование дентальных имплантатов стало распространенным методом лечения частичной и полной адентии. Зарегистрированные отдаленные результаты являются достаточно успешными, однако процесс имплантации также не застрахован и от осложнений, которые могут возникнуть в связи с несоответственным хирургическим лечением или протезированием, недостаточностью материальной базы или неадекватной непосредственной или долгосрочной поддержкой. Все это, в конечном счете, приводит к периимплантитным нарушениям как мягких, так и твердых тканей. Периимплантитная патология характеризуется развитием воспалительной реакции и может быть представлена в двух формах: перимукозит и периимплантит.
Перимукозит представляет собой воспаление мягких тканей без потери подлежащей кости вокруг имплантатов. Он характеризуется кровоточивостью при зондировании, нагноением; глубина зондирования при этом меньшая или равна 4 мм. В противоположность этому, периимплантит характеризируется как воспалительным процессом мягких тканей, так и потерей костной ткани вокруг имплантата.
И Fransson, и Roos-Jansaker с коллегами отметили, что перимукозит регистрируется в 48% случаев имплантации при повторных проверках на протяжении 14 лет. Показатели распространенности периимплантитов варьируют. Критерии диагностики данной патологии такие же, как и для диагностики перимукозитов, но с дополнительными рентгенологическими признаками убыли альвеолярной костной ткани, которая, по оценкам специалистов, проявляется у 11-47% пациентов.
Понимание того, что перимукозиты и периимплантиты могут возникнуть почти в 50% случаев, поднимает сложный вопрос их правильного лечения в стоматологической практике.
Этиология болезни
Принято считать, что перимукозит является первой стадией периимплантита, подобно гингивиту, который является предвестником пародонтита. Также известно, что возникновение периимплантита связано с грамотрицательными анаэробными бактериями, схожими с теми, которые идентифицируются вокруг естественных зубов у пациентов с генерализованным хроническим пародонтитом. После того, как бактерии оседают на поверхности титана, формируется биопленка, которая является неотъемлемой частью в инициации периимплантита. Успех в лечении периимплатита возможен лишь при условии устранения биопленки из поверхности имплантата. Такой подход является ключевым и в лечении перимукозита.
Периимплантиты так же, как и тяжелые поражения пародонта, вызываются более сложными инфекциями, чем перимукозиты. Генерализованная бактериальная контаминация наряду со снижением иммунного ответа заканчивается значительной потерей костной ткани вокруг имплантата. Как отмечалось ранее, в дополнение к золотистому стафилококку, характерному для ранних стадий патологии, грамотрицательные анаэробы лидируют по численности при периимплантитных поражениях. Другие микроорганизмы, присутствующие в 60% случаев периимплантита, представлены Prevotella InterMedia, Porphyromonas gingivalis, Aggregatibacter, Treponema denticola, Fusobacterium nucleatum, Prevotella nigrescens и Peptosteptococcus micros. Иные маркеры характерны как для пародонтальных патологий, так и для тяжелых форм периимплантита, и представлены серией интерлейкинов (IL) -1, IL-6, IL-8, IL -12, щелочных фосфатаз, и активностью эластазы.
Помня о том, что основной целью лечения как периимплантитов, так и перимукозитов является удаление биопленки с поверхности имплантата, не следует забывать о дополнительной стерилизации и деконтаминации пораженной поверхности имплантата. Факторы риска развития перимукозита и периимплантита схожи с таковыми при гингивите и пародонтите. Ниже приведен перечень некоторых из этих факторов:
- неадекватное протезирование;
- дефицит кератинизированных тканей вокруг абатмента;
- излишки цемента, оставленные в периимплантитном пространстве;
- курение;
- генетические факторы;
- коррозия;
- чрезмерная окклюзионная нагрузка;
- неэффективное хирургическое лечение;
- раннее перенесенные болезни пародонта.
При устранении вышеуказанных причин клинические симптомы перимукозитов и периимплантитов значительно уменьшаются. Кроме того, учет влияния данных факторов в процессе планирования лечения поможет достичь эффективных результатов у пациентов более восприимчивым к развитию периимплантатных патологий. При этом вполне вероятно, что могут быть рекомендованы другие методы лечения.
Все стоматологические имплантаты устанавливаются через слизистый слой в ткань подлежащей кости. Данный слой слизистой вокруг имплантата является барьером, который препятствует попаданию патогенных субстанций, таких как бактериальный налет, токсины или остатки органических веществ, которые могут инициировать воспаление тканей и повреждение клеток. После того, как биологический барьер нарушается, начинают возникать признаки перимукозита и/или периимплантита. Таким образом, одним из лучших подходов к лечению является ранняя диагностика проблемы с последующей немедленной коррекцией провоцирующего фактора.
Постановка диагноза
Постановка соответственного диагноза проводится с использованием методов диагностики, аналогичных при верификации патологий пародонта. Важно проводить зондирование области периимплантной бороздки под легким давлением, поскольку периимплантитный барьер слизистой оболочки является чрезвычайно деликатным образованием. Проведение периапикальной рентгенографии необходимо, чтобы определить уровень имплантата сразу же после функциональной нагрузки. Специфическое стоматологическое сканирование с использованием томографа является весьма полезным методом диагностики, поскольку помогает определить периимплантитные поражения, как с щечной, так и с лингвальной сторон, которые могут быть не видны на периапикальных рентгенограммах.
Если при повторном зондировании во время последующих клинических визитов возникает кровотечение, – это первый признак воспаления, а возможные признаки нагноения свидетельствуют об инициации действия бактериальных патогенов. Такие симптомы – следствие нарушения периимплантного барьера; они требуют проведения дополнительной рентгенографии, клинической оценки и выбора алгоритма лечения. Дополнительная диагностика состоит из рентгенографии, определения уровня стабильности и показателей остеинтеграции, бактериальной микрофлоры и биомаркеров воспаления. Данные методы являются полезными как в постановке диагноза, так и в определении клинических протоколов для лечения или стабилизации воспалительного процесса.
Варианты лечения
После того, как диагноз перимукозита или периимплантита был установлен, остается сделать выбор между нехирургическим или хирургическим подходом к лечению. Удаление контаминированных частиц и биопленки является важным шагом в алгоритме лечения поражений. Нехирургический подход оправдан при лечении перимукозитов, нежели в случаях периимплантитов. Такой подход состоит из выполнения кюретажа углеродным волокном, титановой насадкой или ультразвуковыми приборами, локальной медикаментозной терапии, применения антисептиков и принципов лазерного лечения. Schar и коллеги доказали, что нехирургические методы лечения могут быть полезны для снижения признаков воспаления слизистой оболочки до 6 месяцев, но полного разрешения воспаления с их использованием достигнуть крайне трудно. Mombelli и коллеги заявили, что местное или системное лечение периимплантита может иметь положительное влияние на стабилизацию клинических или микробиологических параметров, но полученные результаты не демонстрируют значительного влияния консервативного лечения на разрешение глубоких периимплантитных патологий.
Хирургическое лечение периимплантита обеспечивает лучший доступ к области имплантата и позволяет приступить к выполнению дальнейших процедур, необходимых для коррекции периимплантитных тканей и регенерации кости. Множество авторов представило огромное количество клинических случаев, которые доказывают эффективность различных методов хирургического лечения периимплантитных патологий. Хирургические методы для каждого клинического случая варьируют: это и проведение механической очистки поверхности имплантата, удаление участков поверхности, контаминированных продуктами распада, локализованное использование медикаментозной терапии и противомикробных препаратов на поверхности имплантата, лазерная терапия с последующей костной пластикой. Mombelli пришел к выводу, что хирургический доступ через сепарацию полного лоскута позволяет провести тщательную очистку контаминированной поверхности имплантата, что в сочетании с системным приемом антибиотиков и соответствующими хирургическими методами костной пластики, является наиболее эффективным при лечении периимплантитных дефектов.
Использование лазерной терапии при стабилизации и деконтаминации пораженной поверхности имплантата продемонстрировало перспективные первоначальные результаты. Углеродный (CO2) и Nd:YAG (неодимовый) лазеры являются наиболее широко использованными в челюстно-лицевой хирургии. Однако, их использование чревато возможностью увеличения температуры до значений, которые могут инициировать структурные нарушения, как имплантата, так и окружающей кости. Тем не менее, Kreisler и коллеги продемонстрировали, что СО2-лазер может быть использован на низкой мощности во избежание термических повреждений поверхности имплантата. Er:YAG (эрбиевый) лазер используется в челюстно-лицевой хирургии благодаря своим возможностям точного разделения твердых и мягких тканей с незначительным тепловым эффектом. При этом он не изменяет периимплантитный барьер и не влияет на остеоинтеграцию. Er,Cr:YSGG (эрбиево-хромный) лазер показан для минимизации эффектов послеоперационной боли и ускорения заживления на второй стадии имплантации с минимальным сопутствующим тепловым эффектом на границе имплантат-кость.
Нижеописанные клинические случаи иллюстрируют алгоритм лечения периимплантитных дефектов с использованием Er,Cr:YSGG (эрбиево-хромового) лазера для коррекции периимплантитных патологий средней и высокой степени тяжести. Следующий протокол лечения был использован авторами на протяжении более чем 3 лет для коррекции подобных случаев.
- Назначение антибиотиков: аугментин 875 мг, 20 таблеток. По одной таблетке каждые 12 часов, начиная со дня, который предшествовал процедуре. При возможной аллергии к производным пенициллина: леваквин 500 мг, 10 таблеток. По 1 таблетке каждый день до полного выздоровления.
- Приготовление PRP (плазмы с высоким содержанием тромбоцитов). 20 мл крови забирают до начала процедуры и центрифугируют до получения концентрированного тромбоцитарного геля (минимум 1 млн тромбоцитов).
- Дегрануляция инфицированной периимплантитной ткани.
- Удаление контаминаций с поверхности имплантата с помощью пьезоэлектрического скейлера (механическая очистка). Тромбоцитарным гелем покрывают всю пораженную поверхность имплантата.
- Деконтаминация лимонной кислотой (pH=1) (антисептическое лечение). Нанесение кисточкой на поверхность имплантата на 3 минуты, промывание.
- Бактериальная деконтаминация и устранение остатков воспаленных тканей путем применения Er,Cr:YSGG (эрбиево-хромового) лазера. Мощность лазера – 6 Вт, соотношение вода/воздух: 30%/30%.
- Наложение PRP-мембраны.
- Установка комплекса PRP-мембрана/костный материал. Минерализированная губчастая кость с частицами 1-2 мм.
- Наложение PRP-мембраны поверх костного заменителя.
- Ушивание.
Клинический случай 1
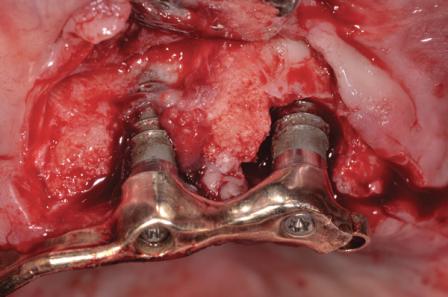
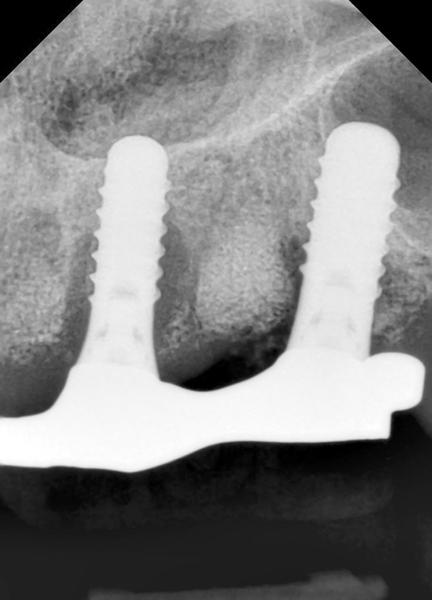
66-летний некурящий мужчина обратился за имплантологической помощью по поводу нижней челюсти. Несколько лет назад на верхней челюсти у него были установлены имплантаты непосредственно после удаления оставшихся зубов. Четыре верхнечелюстных имплантата были использованы как опора под съемный протез. В ходе визита у пациента во время зондирования обнаружена глубина карманов более 8 мм около двух из четырех имплантатов верхней челюсти, нагноение и кровотечение при зондировании (фото 1). На рентгенограмме обнаружены большие вертикальные дефекты с потерей кости по диаметру (фото 2). Пациент согласился пройти курс лечения для устранения клинических признаков и симптомов периимплантита, а также для восстановления подлежащей костной ткани.
Фото 1. Вид периимплантитной патологии перед лечением.
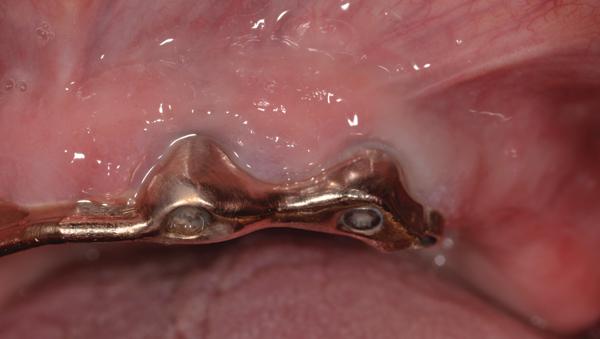
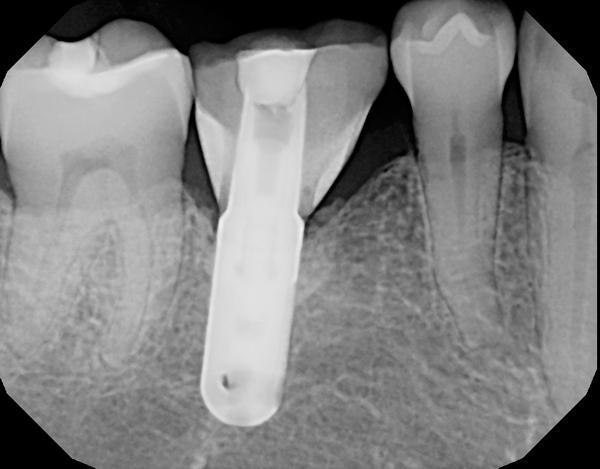
Фото 2. Периапикальная ренгенограмма дефекта перед лечением.
Пациенту было предписано применение антибиотиков перорально за день до начала операции (аугментин 875 мг, 20 таблеток, по 1 таблетке каждые 12 часов). После местной анестезии был отсепарирован полный слизисто-периостальный лоскут. Вид периимплантитных повреждений до начала лечения продемонстрирован на фото 3. После хирургической обработки, применения химической очистки и лазерной дезактивации (Er, Cr: YSGG, Biolase) понадобилось провести костную пластику крупных перимплантитных дефектов (фото 4). Обогащенную тромбоцитами плазму (PRP) и аллогенный минерализованный трансплантат губчатой кости с частицами размером 1-2 мм разместили в области периимплантитных дефектов (фото 5), а затем накрыли область PRP-активной дополнительной мембраной. Ушивание раны проводили 5,0 Monocryl нитями (Ethicon) с непрерывным наложением швов (фото 6). После этого пациент продолжал курс приема системных антибиотиков, а также полоскание хлоргексидином два раза в день в течение 14 дней после операции. Пациента также проинформировали об особенностях гигиены полости рта, после чего установили протез и провели коррекцию прикуса. Сравнение периапикальной рентгенограммы (фото 7), выполненной через полтора года после операции, с начальным снимком (фото 2) демонстрирует эффективность лечения периимплантитных костных дефектов. Глубина зондирования через 1,5 года после операции не превышала 4 мм в области имплантатов.
Фото 3. Периимплантит.
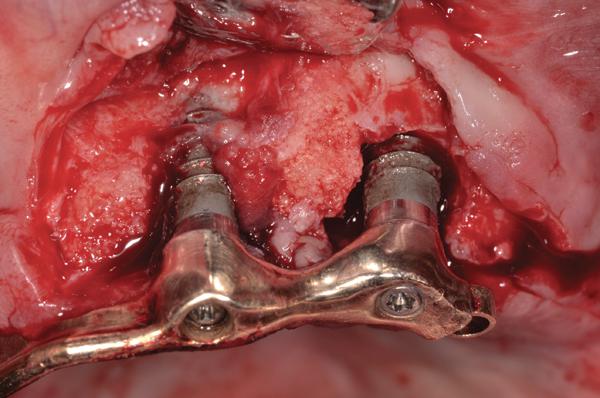
Фото 4. Вид деконтаминированных имплантатов.
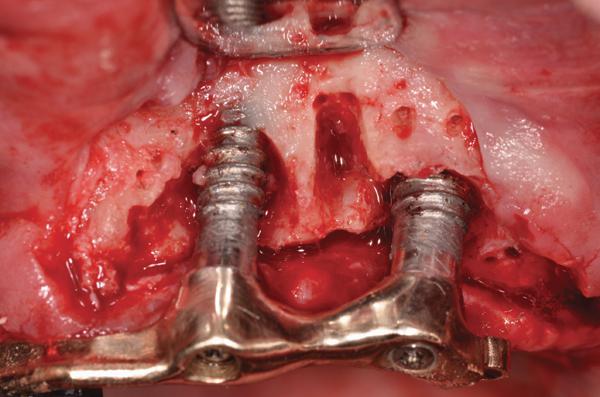
Фото 5. Комплекс PRP/костный материал, установленный в зону периимплантитного дефекта.
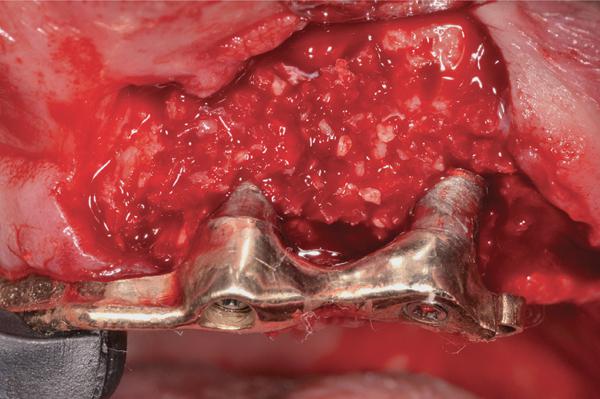
Фото 6. Ушивание 5.0 Monocryl нитями.
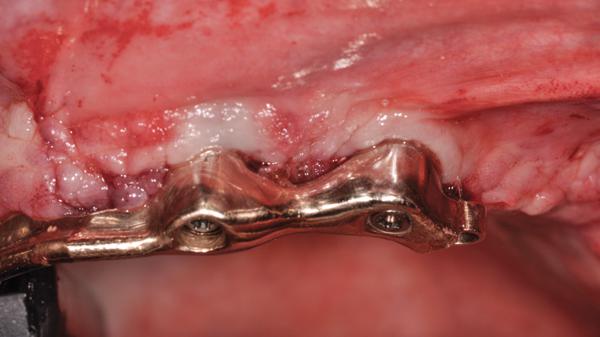
Фото 7. Вид через полтора года после лечения.
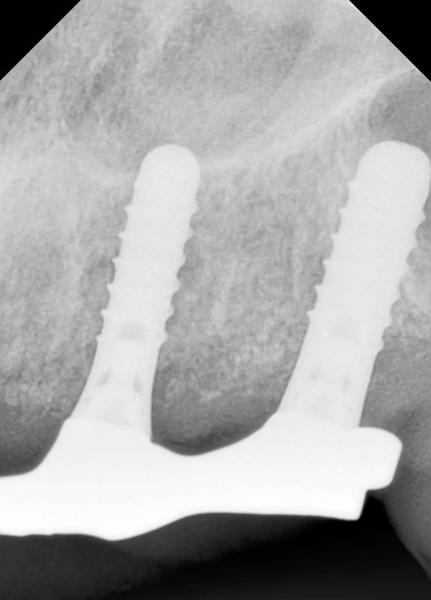
Клинический случай 2
62-летняя некурящая женщина обратилась за помощью по поводу чрезмерной глубины карманов вокруг имплантатов, установленных примерно 6 лет назад (фото 8). Периимплантитные ткани в области первого правого нижнего моляра лишены ороговевшей ткани десны, а глубина зондирования периимплантатной области составляет более чем 10 мм, при этом даже при легком зондировании возникает кровотечение. На предварительной периапикальной рентгенограмме были диагностированы мезиальный и дистальный вертикальные дефекты (фото 9). Пациентка согласилась пройти лечение периимплантита согласно вышеупомянутому алгоритму. После системного приема антибиотиков и соответствующей местной анестезии коронка была удалена с имплантата (фото 10). Форма апикальной части протеза, очевидно, представляла собой возможный фактор инициации патологии, поскольку не позволяла пациенту тщательно очистить область десневой борозды в области установленной конструкции.
Фото 8. Вид перед лечением.
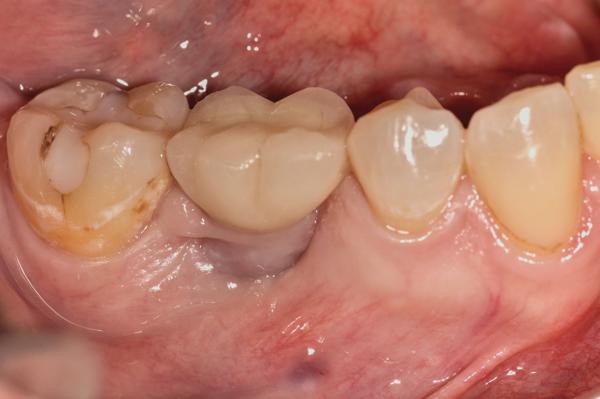
Фото 9. Периапикальная ренгенограмма перед лечением.
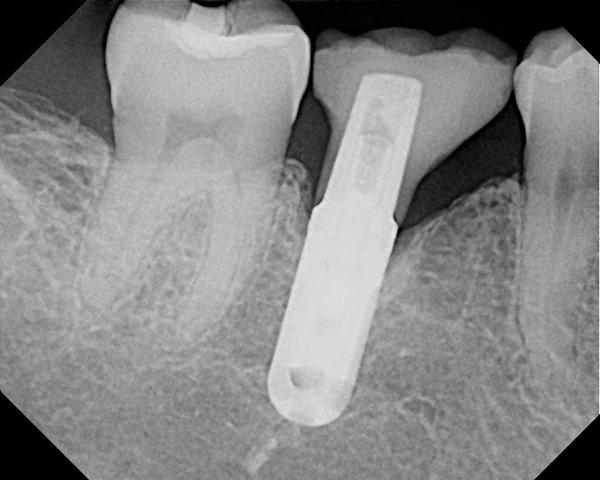
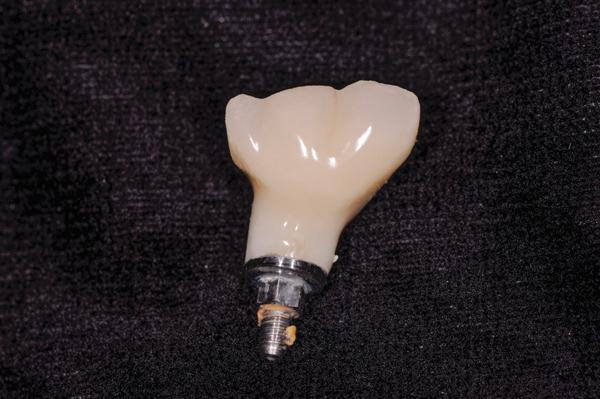
Фото 10. Существующая реставрация на имплантате.
После сепарации полного лоскута костный дефект выглядел как кольцевой дефицит окружающей костной ткани (фото 11). После механической очистки, химической детоксикации и деконтаминации область открытой поверхности имплантата и смежной кости лечили согласно протоколам аугментации (фото 12). Перед повторной фиксацией коронки керамическую поверхность ее апикальной трети протравили и откорректировали с помощью композиционного материала до необходимой формы, которая обеспечивала бы более подходящие условия для очистки области десневой бороздки. Комплекс PRP-трансплантат был помещен в область дефекта и накрыт PRP-биологически активной мембраной (фото 13). После этого был установлен PRP-бесклеточный кожный имплантат (LifeNet) для увеличения толщины соединительной ткани с лицевой стороны поверхности имплантата (фото 14). Закрытие раны проводили путем наложения непрерывных швов 5,0 Monocryl нитью. Пациенту было предписано продолжать системный прием аугментина, а также полоскания раствором хлоргексидина два раза в день в течение 2 недель после операции. Клинические фотографии (фото 15) через 1 год после лечения демонстрируют отличное состояние мягких тканей и стабильность области прикрепления. Сравнивая периапикальные рентгеновские снимки (фото 16, фото 9), невозможно не заметить эффективного восстановления кости вокруг медиальных и дистальных поверхностей имплантата.
Фото 11. Присутствующий периимплантитный дефект.
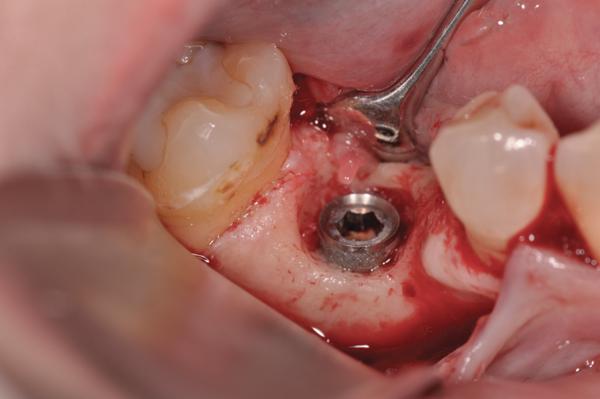
Фото 12. Деконтаминированная поверхность имплантата.
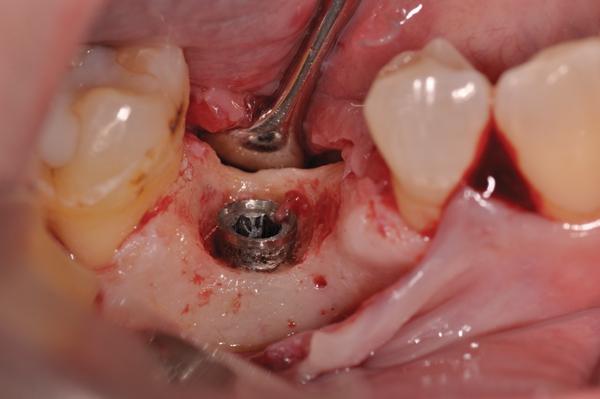
Фото 13. Вид откорректированной поверхности, комплекс PRP/костный материал.
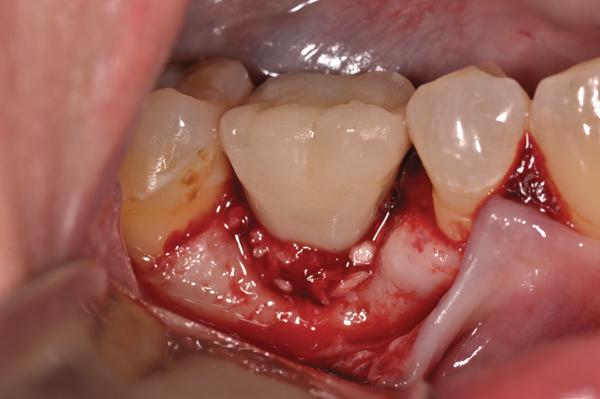
Фото 14. Установленный бесклеточный кожный матрикс.
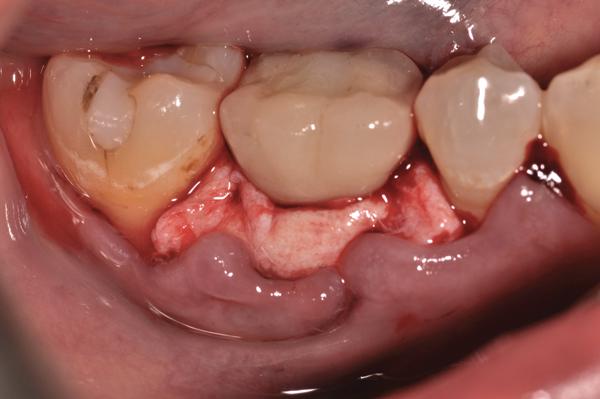
Фото 15. Клинический вид через год после лечения.
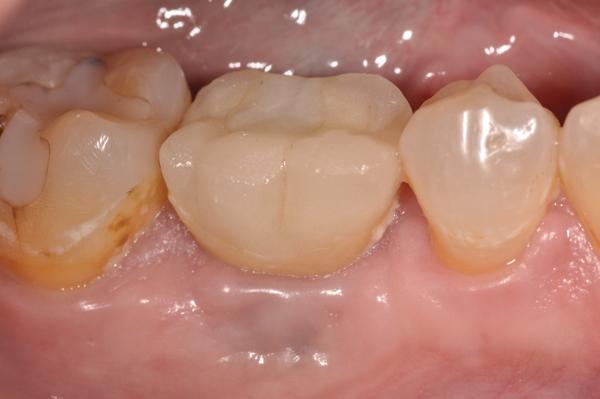
Фото 16. Периапикальная рентгенограмма через 1 год после лечения.
Обсуждение
Врачи обязаны быть готовыми к случаям перимукозитов и периимплантитов, чтобы обеспечить их раннюю диагностику и лечение до того, как патологии достигнут своих терминальных стадий. Случаи перимукозитов в перспективе имеют более благоприятный исход, если возможно устранение этиологического фактора. Консервативные нехирургические методы удаления биопленки, согласно данных литературы, обеспечивают благоприятный исход подобных воспалений. С другой стороны, поражения по типу периимплантита гораздо труднее поддаются лечению, а нехирургический подход не обеспечивает положительных исходов при подобных нарушениях. Сепарация лоскута обеспечивает доступ к открытой поверхности имплантата, что позволяет провести более эффективную санацию, дезактивацию и деконтаминацию пораженных поверхностей с помощью хирургических методов. Разнообразие имплантационных систем, доступных для врача на сегодняшний день, обосновывает различные подходы в лечении конкретных поверхностей, но обсуждение выбора имплантата для каждой специфической клинической ситуации выходит за рамки данной статьи.
Протокол лечения периимплантитных поражений включает в себя не только механическую очистку, химическую детоксикацию и использование Cr,Er:YSGG лазеров для обеззараживания инфицированной поверхности имплантата, но также обосновывает необходимость прямой аугментации кости. Автор лично использовал данный протокол более чем в 50 случаях и рекомендует проведение обширных клинических исследований для подтверждения эффективности результатов и указанного протокола при более широкой выборке.
Выводы
Дентальная имплантация стала неотъемлемой частью плана лечения стоматологических пациентов в каждодневной практике. Как и в случае с естественными зубами, локализованные инфекции полиэтиологической природы могут развиваться и вокруг имплантатов. Частота возникновения перимукозитов и периимплантитов представляет собой серьезную проблему в отношении прогнозирования отдаленных успешных результатов хирургического и восстановительного лечения, а протокол их лечения нуждается в детальной разработке с учетом принципов доказательной медицины.
Автор: Paul S. Petrungaro, DDS, MS
Использование дентальных имплантатов стало распространенным методом лечения частичной и полной адентии. Зарегистрированные отдаленные результаты являются достаточно успешными, однако процесс имплантации также не застрахован и от осложнений, которые могут возникнуть в связи с несоответственным хирургическим лечением или протезированием, недостаточностью материальной базы или неадекватной непосредственной или долгосрочной поддержкой. Все это, в конечном счете, приводит к периимплантитным нарушениям как мягких, так и твердых тканей. Периимплантитная патология характеризуется развитием воспалительной реакции и может быть представлена в двух формах: перимукозит и периимплантит.

Перимукозит представляет собой воспаление мягких тканей без потери подлежащей кости вокруг имплантатов. Он характеризуется кровоточивостью при зондировании, нагноением; глубина зондирования при этом меньшая или равна 4 мм. В противоположность этому, периимплантит характеризируется как воспалительным процессом мягких тканей, так и потерей костной ткани вокруг имплантата.
И Fransson, и Roos-Jansaker с коллегами отметили, что перимукозит регистрируется в 48% случаев имплантации при повторных проверках на протяжении 14 лет. Показатели распространенности периимплантитов варьируют. Критерии диагностики данной патологии такие же, как и для диагностики перимукозитов, но с дополнительными рентгенологическими признаками убыли альвеолярной костной ткани, которая, по оценкам специалистов, проявляется у 11-47% пациентов.
Понимание того, что перимукозиты и периимплантиты могут возникнуть почти в 50% случаев, поднимает сложный вопрос их правильного лечения в стоматологической практике.
Этиология болезни
Принято считать, что перимукозит является первой стадией периимплантита, подобно гингивиту, который является предвестником пародонтита. Также известно, что возникновение периимплантита связано с грамотрицательными анаэробными бактериями, схожими с теми, которые идентифицируются вокруг естественных зубов у пациентов с генерализованным хроническим пародонтитом. После того, как бактерии оседают на поверхности титана, формируется биопленка, которая является неотъемлемой частью в инициации периимплантита. Успех в лечении периимплатита возможен лишь при условии устранения биопленки из поверхности имплантата. Такой подход является ключевым и в лечении перимукозита.
Периимплантиты так же, как и тяжелые поражения пародонта, вызываются более сложными инфекциями, чем перимукозиты. Генерализованная бактериальная контаминация наряду со снижением иммунного ответа заканчивается значительной потерей костной ткани вокруг имплантата. Как отмечалось ранее, в дополнение к золотистому стафилококку, характерному для ранних стадий патологии, грамотрицательные анаэробы лидируют по численности при периимплантитных поражениях. Другие микроорганизмы, присутствующие в 60% случаев периимплантита, представлены Prevotella InterMedia, Porphyromonas gingivalis, Aggregatibacter, Treponema denticola, Fusobacterium nucleatum, Prevotella nigrescens и Peptosteptococcus micros. Иные маркеры характерны как для пародонтальных патологий, так и для тяжелых форм периимплантита, и представлены серией интерлейкинов (IL) -1, IL-6, IL-8, IL -12, щелочных фосфатаз, и активностью эластазы.
Помня о том, что основной целью лечения как периимплантитов, так и перимукозитов является удаление биопленки с поверхности имплантата, не следует забывать о дополнительной стерилизации и деконтаминации пораженной поверхности имплантата. Факторы риска развития перимукозита и периимплантита схожи с таковыми при гингивите и пародонтите. Ниже приведен перечень некоторых из этих факторов:
- неадекватное протезирование;
- дефицит кератинизированных тканей вокруг абатмента;
- излишки цемента, оставленные в периимплантитном пространстве;
- курение;
- генетические факторы;
- коррозия;
- чрезмерная окклюзионная нагрузка;
- неэффективное хирургическое лечение;
- раннее перенесенные болезни пародонта.
При устранении вышеуказанных причин клинические симптомы перимукозитов и периимплантитов значительно уменьшаются. Кроме того, учет влияния данных факторов в процессе планирования лечения поможет достичь эффективных результатов у пациентов более восприимчивым к развитию периимплантатных патологий. При этом вполне вероятно, что могут быть рекомендованы другие методы лечения.
Все стоматологические имплантаты устанавливаются через слизистый слой в ткань подлежащей кости. Данный слой слизистой вокруг имплантата является барьером, который препятствует попаданию патогенных субстанций, таких как бактериальный налет, токсины или остатки органических веществ, которые могут инициировать воспаление тканей и повреждение клеток. После того, как биологический барьер нарушается, начинают возникать признаки перимукозита и/или периимплантита. Таким образом, одним из лучших подходов к лечению является ранняя диагностика проблемы с последующей немедленной коррекцией провоцирующего фактора.
Постановка диагноза
Постановка соответственного диагноза проводится с использованием методов диагностики, аналогичных при верификации патологий пародонта. Важно проводить зондирование области периимплантной бороздки под легким давлением, поскольку периимплантитный барьер слизистой оболочки является чрезвычайно деликатным образованием. Проведение периапикальной рентгенографии необходимо, чтобы определить уровень имплантата сразу же после функциональной нагрузки. Специфическое стоматологическое сканирование с использованием томографа является весьма полезным методом диагностики, поскольку помогает определить периимплантитные поражения, как с щечной, так и с лингвальной сторон, которые могут быть не видны на периапикальных рентгенограммах.
Если при повторном зондировании во время последующих клинических визитов возникает кровотечение, – это первый признак воспаления, а возможные признаки нагноения свидетельствуют об инициации действия бактериальных патогенов. Такие симптомы – следствие нарушения периимплантного барьера; они требуют проведения дополнительной рентгенографии, клинической оценки и выбора алгоритма лечения. Дополнительная диагностика состоит из рентгенографии, определения уровня стабильности и показателей остеинтеграции, бактериальной микрофлоры и биомаркеров воспаления. Данные методы являются полезными как в постановке диагноза, так и в определении клинических протоколов для лечения или стабилизации воспалительного процесса.
Варианты лечения
После того, как диагноз перимукозита или периимплантита был установлен, остается сделать выбор между нехирургическим или хирургическим подходом к лечению. Удаление контаминированных частиц и биопленки является важным шагом в алгоритме лечения поражений. Нехирургический подход оправдан при лечении перимукозитов, нежели в случаях периимплантитов. Такой подход состоит из выполнения кюретажа углеродным волокном, титановой насадкой или ультразвуковыми приборами, локальной медикаментозной терапии, применения антисептиков и принципов лазерного лечения. Schar и коллеги доказали, что нехирургические методы лечения могут быть полезны для снижения признаков воспаления слизистой оболочки до 6 месяцев, но полного разрешения воспаления с их использованием достигнуть крайне трудно. Mombelli и коллеги заявили, что местное или системное лечение периимплантита может иметь положительное влияние на стабилизацию клинических или микробиологических параметров, но полученные результаты не демонстрируют значительного влияния консервативного лечения на разрешение глубоких периимплантитных патологий.
Хирургическое лечение периимплантита обеспечивает лучший доступ к области имплантата и позволяет приступить к выполнению дальнейших процедур, необходимых для коррекции периимплантитных тканей и регенерации кости. Множество авторов представило огромное количество клинических случаев, которые доказывают эффективность различных методов хирургического лечения периимплантитных патологий. Хирургические методы для каждого клинического случая варьируют: это и проведение механической очистки поверхности имплантата, удаление участков поверхности, контаминированных продуктами распада, локализованное использование медикаментозной терапии и противомикробных препаратов на поверхности имплантата, лазерная терапия с последующей костной пластикой. Mombelli пришел к выводу, что хирургический доступ через сепарацию полного лоскута позволяет провести тщательную очистку контаминированной поверхности имплантата, что в сочетании с системным приемом антибиотиков и соответствующими хирургическими методами костной пластики, является наиболее эффективным при лечении периимплантитных дефектов.
Использование лазерной терапии при стабилизации и деконтаминации пораженной поверхности имплантата продемонстрировало перспективные первоначальные результаты. Углеродный (CO2) и Nd:YAG (неодимовый) лазеры являются наиболее широко использованными в челюстно-лицевой хирургии. Однако, их использование чревато возможностью увеличения температуры до значений, которые могут инициировать структурные нарушения, как имплантата, так и окружающей кости. Тем не менее, Kreisler и коллеги продемонстрировали, что СО2-лазер может быть использован на низкой мощности во избежание термических повреждений поверхности имплантата. Er:YAG (эрбиевый) лазер используется в челюстно-лицевой хирургии благодаря своим возможностям точного разделения твердых и мягких тканей с незначительным тепловым эффектом. При этом он не изменяет периимплантитный барьер и не влияет на остеоинтеграцию. Er,Cr:YSGG (эрбиево-хромный) лазер показан для минимизации эффектов послеоперационной боли и ускорения заживления на второй стадии имплантации с минимальным сопутствующим тепловым эффектом на границе имплантат-кость.
Нижеописанные клинические случаи иллюстрируют алгоритм лечения периимплантитных дефектов с использованием Er,Cr:YSGG (эрбиево-хромового) лазера для коррекции периимплантитных патологий средней и высокой степени тяжести. Следующий протокол лечения был использован авторами на протяжении более чем 3 лет для коррекции подобных случаев.
- Назначение антибиотиков: аугментин 875 мг, 20 таблеток. По одной таблетке каждые 12 часов, начиная со дня, который предшествовал процедуре. При возможной аллергии к производным пенициллина: леваквин 500 мг, 10 таблеток. По 1 таблетке каждый день до полного выздоровления.
- Приготовление PRP (плазмы с высоким содержанием тромбоцитов). 20 мл крови забирают до начала процедуры и центрифугируют до получения концентрированного тромбоцитарного геля (минимум 1 млн тромбоцитов).
- Дегрануляция инфицированной периимплантитной ткани.
- Удаление контаминаций с поверхности имплантата с помощью пьезоэлектрического скейлера (механическая очистка). Тромбоцитарным гелем покрывают всю пораженную поверхность имплантата.
- Деконтаминация лимонной кислотой (pH=1) (антисептическое лечение). Нанесение кисточкой на поверхность имплантата на 3 минуты, промывание.
- Бактериальная деконтаминация и устранение остатков воспаленных тканей путем применения Er,Cr:YSGG (эрбиево-хромового) лазера. Мощность лазера – 6 Вт, соотношение вода/воздух: 30%/30%.
- Наложение PRP-мембраны.
- Установка комплекса PRP-мембрана/костный материал. Минерализированная губчастая кость с частицами 1-2 мм.
- Наложение PRP-мембраны поверх костного заменителя.
- Ушивание.
Клинический случай 1
66-летний некурящий мужчина обратился за имплантологической помощью по поводу нижней челюсти. Несколько лет назад на верхней челюсти у него были установлены имплантаты непосредственно после удаления оставшихся зубов. Четыре верхнечелюстных имплантата были использованы как опора под съемный протез. В ходе визита у пациента во время зондирования обнаружена глубина карманов более 8 мм около двух из четырех имплантатов верхней челюсти, нагноение и кровотечение при зондировании (фото 1). На рентгенограмме обнаружены большие вертикальные дефекты с потерей кости по диаметру (фото 2). Пациент согласился пройти курс лечения для устранения клинических признаков и симптомов периимплантита, а также для восстановления подлежащей костной ткани.
Фото 1. Вид периимплантитной патологии перед лечением.

Фото 2. Периапикальная ренгенограмма дефекта перед лечением.

Пациенту было предписано применение антибиотиков перорально за день до начала операции (аугментин 875 мг, 20 таблеток, по 1 таблетке каждые 12 часов). После местной анестезии был отсепарирован полный слизисто-периостальный лоскут. Вид периимплантитных повреждений до начала лечения продемонстрирован на фото 3. После хирургической обработки, применения химической очистки и лазерной дезактивации (Er, Cr: YSGG, Biolase) понадобилось провести костную пластику крупных перимплантитных дефектов (фото 4). Обогащенную тромбоцитами плазму (PRP) и аллогенный минерализованный трансплантат губчатой кости с частицами размером 1-2 мм разместили в области периимплантитных дефектов (фото 5), а затем накрыли область PRP-активной дополнительной мембраной. Ушивание раны проводили 5,0 Monocryl нитями (Ethicon) с непрерывным наложением швов (фото 6). После этого пациент продолжал курс приема системных антибиотиков, а также полоскание хлоргексидином два раза в день в течение 14 дней после операции. Пациента также проинформировали об особенностях гигиены полости рта, после чего установили протез и провели коррекцию прикуса. Сравнение периапикальной рентгенограммы (фото 7), выполненной через полтора года после операции, с начальным снимком (фото 2) демонстрирует эффективность лечения периимплантитных костных дефектов. Глубина зондирования через 1,5 года после операции не превышала 4 мм в области имплантатов.
Фото 3. Периимплантит.

Фото 4. Вид деконтаминированных имплантатов.

Фото 5. Комплекс PRP/костный материал, установленный в зону периимплантитного дефекта.

Фото 6. Ушивание 5.0 Monocryl нитями.

Фото 7. Вид через полтора года после лечения.

Клинический случай 2
62-летняя некурящая женщина обратилась за помощью по поводу чрезмерной глубины карманов вокруг имплантатов, установленных примерно 6 лет назад (фото 8). Периимплантитные ткани в области первого правого нижнего моляра лишены ороговевшей ткани десны, а глубина зондирования периимплантатной области составляет более чем 10 мм, при этом даже при легком зондировании возникает кровотечение. На предварительной периапикальной рентгенограмме были диагностированы мезиальный и дистальный вертикальные дефекты (фото 9). Пациентка согласилась пройти лечение периимплантита согласно вышеупомянутому алгоритму. После системного приема антибиотиков и соответствующей местной анестезии коронка была удалена с имплантата (фото 10). Форма апикальной части протеза, очевидно, представляла собой возможный фактор инициации патологии, поскольку не позволяла пациенту тщательно очистить область десневой борозды в области установленной конструкции.
Фото 8. Вид перед лечением.

Фото 9. Периапикальная ренгенограмма перед лечением.

Фото 10. Существующая реставрация на имплантате.

После сепарации полного лоскута костный дефект выглядел как кольцевой дефицит окружающей костной ткани (фото 11). После механической очистки, химической детоксикации и деконтаминации область открытой поверхности имплантата и смежной кости лечили согласно протоколам аугментации (фото 12). Перед повторной фиксацией коронки керамическую поверхность ее апикальной трети протравили и откорректировали с помощью композиционного материала до необходимой формы, которая обеспечивала бы более подходящие условия для очистки области десневой бороздки. Комплекс PRP-трансплантат был помещен в область дефекта и накрыт PRP-биологически активной мембраной (фото 13). После этого был установлен PRP-бесклеточный кожный имплантат (LifeNet) для увеличения толщины соединительной ткани с лицевой стороны поверхности имплантата (фото 14). Закрытие раны проводили путем наложения непрерывных швов 5,0 Monocryl нитью. Пациенту было предписано продолжать системный прием аугментина, а также полоскания раствором хлоргексидина два раза в день в течение 2 недель после операции. Клинические фотографии (фото 15) через 1 год после лечения демонстрируют отличное состояние мягких тканей и стабильность области прикрепления. Сравнивая периапикальные рентгеновские снимки (фото 16, фото 9), невозможно не заметить эффективного восстановления кости вокруг медиальных и дистальных поверхностей имплантата.
Фото 11. Присутствующий периимплантитный дефект.

Фото 12. Деконтаминированная поверхность имплантата.

Фото 13. Вид откорректированной поверхности, комплекс PRP/костный материал.

Фото 14. Установленный бесклеточный кожный матрикс.

Фото 15. Клинический вид через год после лечения.

Фото 16. Периапикальная рентгенограмма через 1 год после лечения.

Обсуждение
Врачи обязаны быть готовыми к случаям перимукозитов и периимплантитов, чтобы обеспечить их раннюю диагностику и лечение до того, как патологии достигнут своих терминальных стадий. Случаи перимукозитов в перспективе имеют более благоприятный исход, если возможно устранение этиологического фактора. Консервативные нехирургические методы удаления биопленки, согласно данных литературы, обеспечивают благоприятный исход подобных воспалений. С другой стороны, поражения по типу периимплантита гораздо труднее поддаются лечению, а нехирургический подход не обеспечивает положительных исходов при подобных нарушениях. Сепарация лоскута обеспечивает доступ к открытой поверхности имплантата, что позволяет провести более эффективную санацию, дезактивацию и деконтаминацию пораженных поверхностей с помощью хирургических методов. Разнообразие имплантационных систем, доступных для врача на сегодняшний день, обосновывает различные подходы в лечении конкретных поверхностей, но обсуждение выбора имплантата для каждой специфической клинической ситуации выходит за рамки данной статьи.
Протокол лечения периимплантитных поражений включает в себя не только механическую очистку, химическую детоксикацию и использование Cr,Er:YSGG лазеров для обеззараживания инфицированной поверхности имплантата, но также обосновывает необходимость прямой аугментации кости. Автор лично использовал данный протокол более чем в 50 случаях и рекомендует проведение обширных клинических исследований для подтверждения эффективности результатов и указанного протокола при более широкой выборке.
Выводы
Дентальная имплантация стала неотъемлемой частью плана лечения стоматологических пациентов в каждодневной практике. Как и в случае с естественными зубами, локализованные инфекции полиэтиологической природы могут развиваться и вокруг имплантатов. Частота возникновения перимукозитов и периимплантитов представляет собой серьезную проблему в отношении прогнозирования отдаленных успешных результатов хирургического и восстановительного лечения, а протокол их лечения нуждается в детальной разработке с учетом принципов доказательной медицины.
Автор: Paul S. Petrungaro, DDS, MS


























































































































































0 комментариев